Tenemos una pasión por las soluciones no convencionales que traen su visión a la vida.
CDMO significa Pharmaceutical Contract customir&d and Manufacturing Enterprise, que principalmente proporciona a las compañías farmacéuticas servicios tales como procesos de i + d y preparación, optimización de procesos, producción a escala, registro, verificación de producción y producción comercial. La plataforma única de i + d y producción biofarmacéude las compañías de CDMO generalmente proporciona servicios de extremo a extremo desde el desarrollo de objetivos hasta la producción comercial. Al mismo tiempo, su sistema de gestión de calidad tiene que cumplir con los requisitos de NMPA y la FDA de EE.UU., lo que puede ahorrar mucho tiempo y costo para confiar a las empresas farmacéuticas.
Cinco requisitos básicos para CDMO
Con el fin de competir con éxito por la capacidad de producción, las empresas de CDMO primero invertirán en sus talleres de producción y de i + d que cumplan con los requisitos de GMP. En cuanto al contenido de decoración del taller de producción de llenado GMP, que es muy necesario, primero debe cumplir los requisitos de GMP, pero también los requisitos de proceso, así como los requisitos de construcción y de seguridad y salud. En el diseño de áreas limpias, deben prestarse atención a cinco requisitos básicos, a saber:
Requisitos básicos para el diseño del proceso
Requisitos básicos para la limpieza
Las exigencias básicas para la persona de las habitaciones limpias
Las exigencias básicas para las mercancías de las salas blancas
Requisitos básicos para canales de purificación y diseño
Si se trata de un taller que utiliza un antiguo edificio de la fábrica para la renovación, debemos prestar atención a las cuestiones de diseño, tales como la altura del suelo y tuberías de proceso.
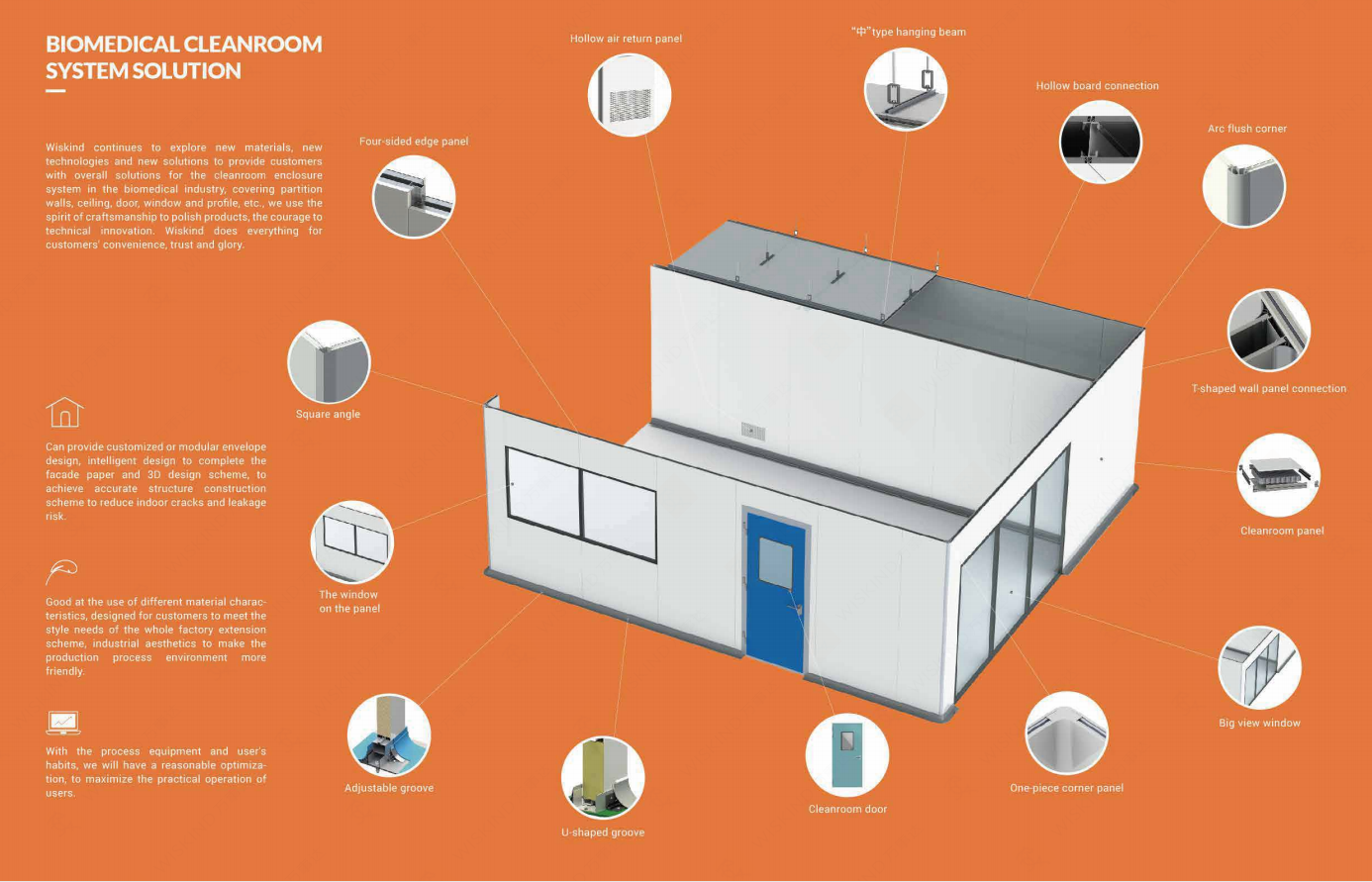 En áreas de operación con un mayor grado de riesgo, tales como llenado, encapsulado, subempaquet, tapado y tapado en el taller de llenado; El entorno para operaciones de proceso tales como trituración, cribado, mezcla y subembalaje de materias primas estériles.Wiskind. Generalmente lleva A cabo el diseño de interiores de acuerdo con las normas de área limpia clase A requeridas por GMP.
En áreas de operación con un mayor grado de riesgo, tales como llenado, encapsulado, subempaquet, tapado y tapado en el taller de llenado; El entorno para operaciones de proceso tales como trituración, cribado, mezcla y subembalaje de materias primas estériles.Wiskind. Generalmente lleva A cabo el diseño de interiores de acuerdo con las normas de área limpia clase A requeridas por GMP.
Al mismo tiempo, el diseño de clase B se lleva A cabo en la zona de fondo donde se encuentra la zona limpia de clase A para operaciones de alto riesgo como la preparación aséptica y el llenado. Otros eslaboperativos menos importantes, tales como: preparación de medicamentos o productos que pueden ser esterilizados y filtrantes antes de su llenado, filtración de productos, materiales de envasado que entran en contacto directo con los medicamentos, limpieza final, montaje o embalaje de los equipos y procesos de esteriliel área limpia donde se ubica está diseñada según clase C y clase D.
Wiskind ha proporcionado con éxito integralSistema de sala limpiaSoluciones para interenational Empresas biofarmacéude CDMO, proporcionando una garantía de esteriliestable para la producción moderna y empodera a los socios en la industria biofarmacéu.

Wiskind Cleanroom se especializa en el sistema de recinto de sala limpia, sistema de techo, puertas y ventanas de sala limpia y el desarrollo de productos relacionados, fabricación, ventas, consultoría y servicios.